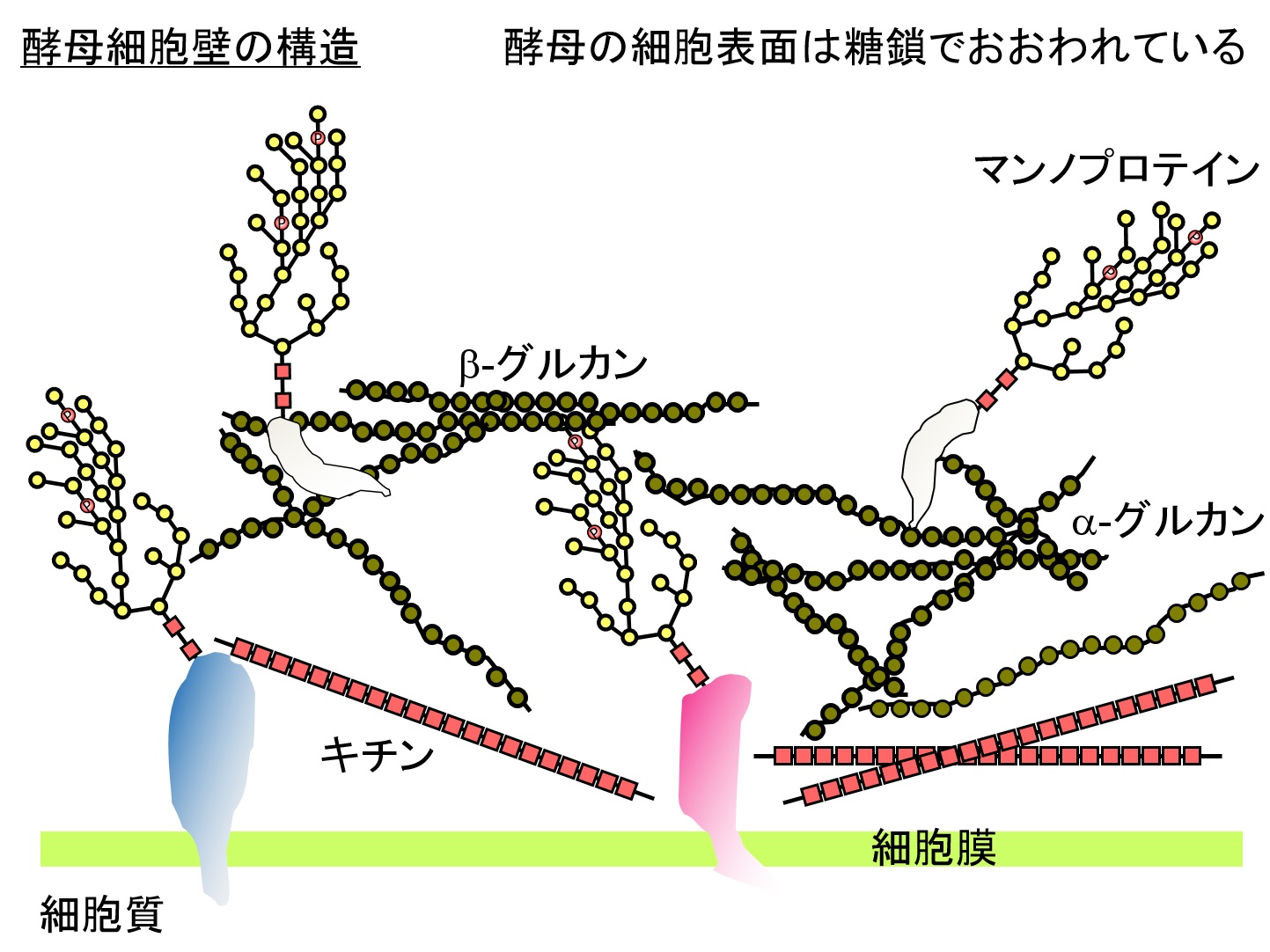
グリコシレーションは真核生物において分泌・膜タンパク質の構造や機能を調節するための主要な共有結合修飾です。とりわけヒトへの治療用途を目的としてタンパク質を生産する場合には、糖タンパク質糖鎖部分の正確な構造に関する情報がとりわけ重要です。しかしながら分裂酵母Schizosaccharomyces pombeを含む酵母の糖鎖構造は哺乳類やヒトのものと大きく異なっており、このことが治療用としての有効性を難しくしています。そのため酵母と哺乳類の糖タンパク質糖鎖構造の違いは生産用宿主として最も大きな問題です。ほとんどの生物の細胞表面に見られるタンパク質には糖鎖が付加しており、多くの場合、この糖タンパク質中の糖鎖は細胞表面を負電荷にすることに貢献しています。この負電化は細胞への物質の流入や排出、細胞同士の接着や病原体の宿主への接着等に重要な役割を担っています。多くの酸性糖、例えばムラミン酸、ヘキスロン酸、シアル酸、コハク酸、乳酸、そしてピルビン酸等は細菌の多糖において発見されています。一般的に、シアル酸や硫酸が付加したグリカンは脊椎動物の糖タンパク質において見られます。出芽酵母(S. cerevisiae、Candida albicans、Pichia pastoris等)では細胞外のグリカンに存在するリン酸基によって細胞表面が負電荷を帯びていますが、C. albicans分離株の中にはグリカン中のガラクトピラノシルにシアル酸がアルファ2,6や2,3結合したものも存在します。
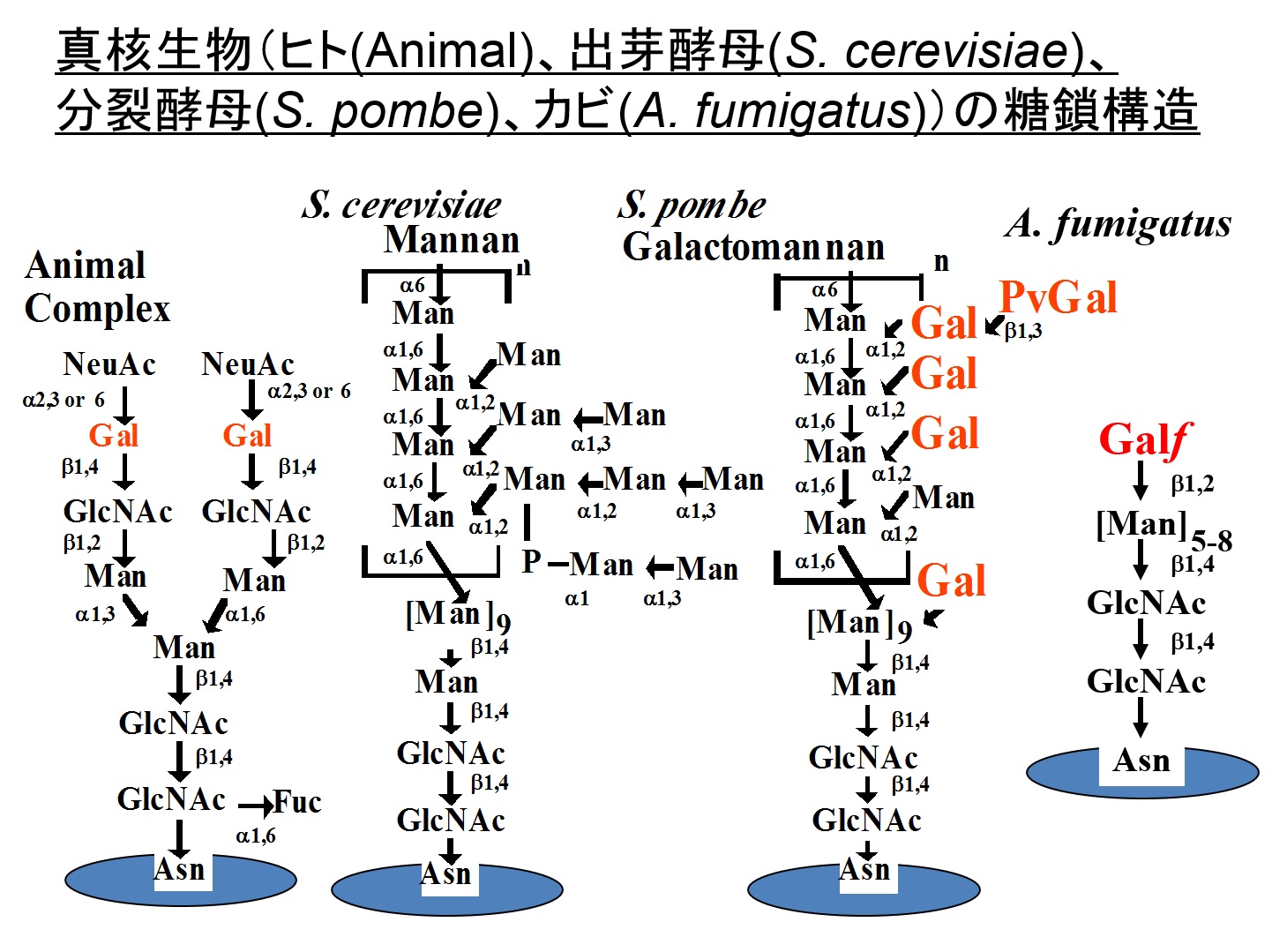
分裂酵母の糖タンパク質には非常に多量のマンノースの他にガラクトースが含まれていることから、分裂酵母は哺乳類と同様にタンパク質へのガラクトース付加の能力が備わっています。分裂酵母では、ゴルジ体内腔でガラクトース転移酵素により糖タンパク質のN-およびO-結合型糖鎖にガラクトース残基が転移されます。我々は、ガラクトース残基は分裂酵母の生育には必須ではないが、タンパク質へのガラクトシル化は細胞形態の維持、性的凝集や各種薬剤に対する抵抗性に重要であることを分裂酵母ガラクトース欠損株を取得して明らかにしました。酵母において細胞表層の糖タンパク質は凝集や菌糸状の侵入性増殖に重要な役割を果たす。我々は分裂酵母のgsf2+遺伝子が細胞表層複合糖質のガラクトース残基と結合する凝集素をコードしていることを見いだしました。分裂酵母の非性的凝集や侵入性増殖はgsf2+遺伝子の発現により厳密にコントロールされていることも明らかにしました。またガラクトース残基のピルビン酸の付加はN-結合型のガラクトマンナンのガラクトース残基を覆うことにより負に制御しています。このように分裂酵母はガラクトースを特異的に認識するシステムを有しており、Gsf2凝集素タンパクが細胞間相互作用を成立させるために必須の役割を果たしていることがわかりました。
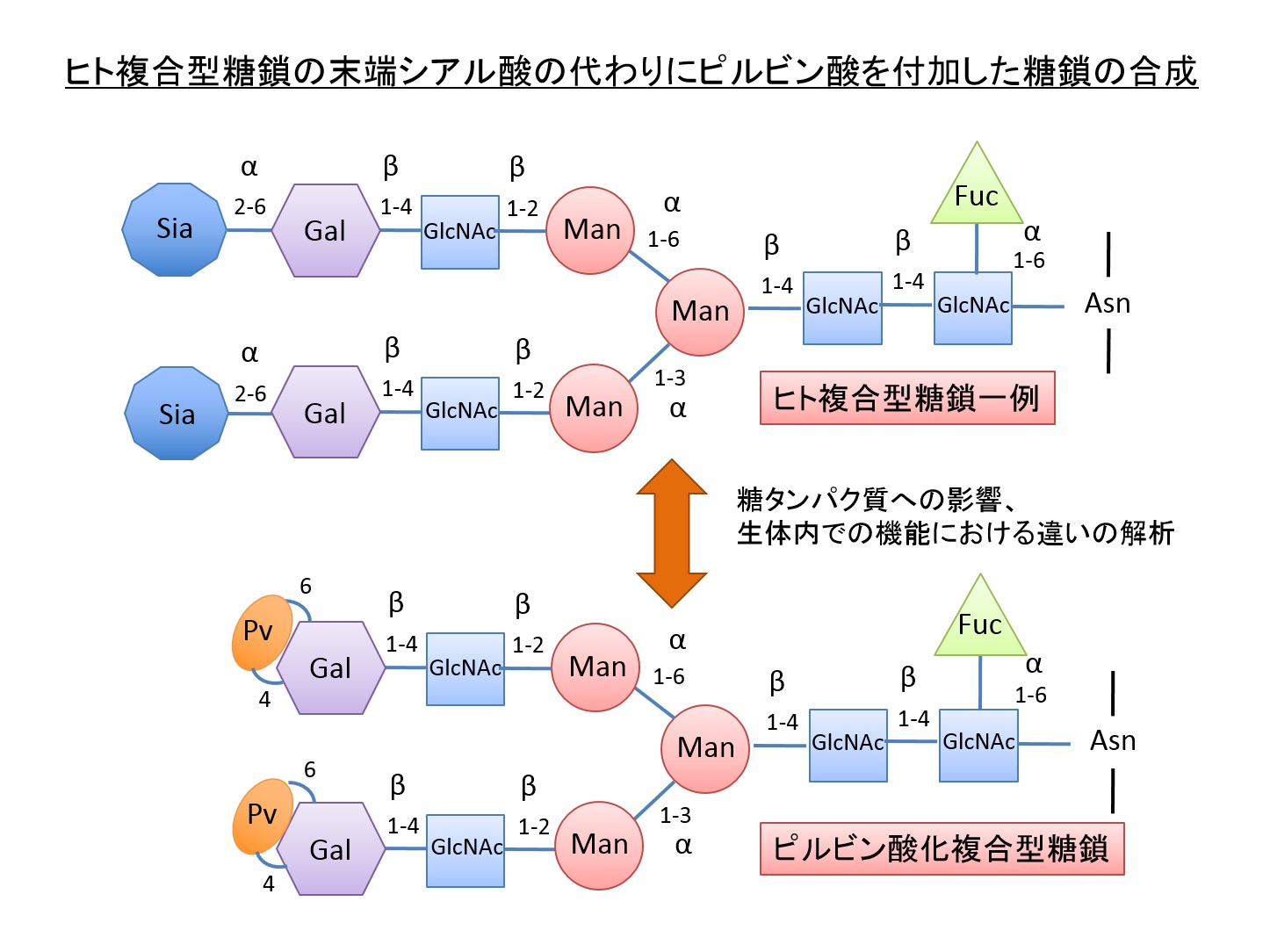
分裂酵母の糖鎖へのピルビン酸の付加は新奇ピルビン酸転移酵素Pvg1が関与しています。我々は大腸菌で生産したPvg1が確かにピルビン酸転移酵素活性を示すことを明らかにしました(Yoritsune et al., FEBS Lett, 2013)。さらに、点変異を加えた本酵素を用いて新たなピルビン酸含有糖鎖が合成できることを示しました(Higuchi et al., Sci Rep, 2016)。これらの糖鎖の機能を解析することで、ピルビン酸化糖鎖の役割を解明したいと考えています。具体的には、糖タンパク質の複合型糖鎖のシアル酸が付加している部分をピルビン酸にすげ替えることで、高等動物の体内でより安定に滞留できる可能性のあるバイオ医薬品の合成を試みています。
最近の発表論文
Higuchi Y, Yoshinaga S, Yoritsune K, Tateno H, Hirabayashi J, Nakakita S, Kanekiyo M, Kakuta Y, Takegawa K:
A rationally engineered yeast pyruvyltransferase Pvg1p introduces sialylation-like properties in neo-human-type complex oligosaccharide.
Sci Rep 6:26349, (2016)
Yoritsune KI, Higuchi Y, Matsuzawa T, Takegawa K:
Functional analysis of putative phosphoenolpyruvate transporters localized to the Golgi apparatus in Schizosaccharomyces pombe.
FEMS Yeast Res 14(7), 1101-1109 (2014)
Yoritune K, Matsuzawa T, Ohashi T, and Takegawa K:
The fission yeast Pvg1p shows galactose-specific pyruvyltransferase activity.
FEBS Lett 587(7), 917-921 (2013)
Matsuzawa T, Kageyama Y, Ooishi K, Kawamukai M, and Takegawa K:
The zinc finger protein Gsf1 regulates Gsf2-dependent flocculation in fission yeast.
FEMS Yeast Res 13(3), 259-266 (2013)
Matsuzawa T, Hara F, Tanaka N, Tohda H and Takegawa K:
ght2+ is required for UDP-galactose synthesis from extracellular galactose by Schizosaccharomyces pombe.
Appl Microbiol Biotechnol 97(11), 4957-4964 (2013)
Ohashi T, Fujiyama K and Takegawa K:
Identification of novel alpha-1,3-galactosyltransferase and elimination of alpha-galactose-containing glycans by disruption of multiple alpha-galactosyltransferase genes in Schizosaccharomyces pombe.
J Biol Chem 287(46), 38866-38875 (2012)
Matsuzawa T, Yoritsune K and Takegawa K:
MADS box transcription factor Mbx2/Pvg4 regulates invasive growth and flocculation by inducing gsf2+ expression in fission yeast.
Eukaryot Cell 11, 151-158 (2012)
Matsuzawa T, Morita T, Tanaka N, Tohda H and Takegawa K:
Identification of a galactose-specific flocculin essential for nonsexual flocculation and hyphal growth in Schizosaccharomyces pombe.
Mol Microbiol 82, 1531-1544 (2011)
Ohashi T, Nakakita S, Sumiyoshi W, Yamada N, Ikeda Y, Tanaka N and Takegawa K:
Structural analysis of alfa-1,3-linked galactose-containing oligosaccharides in Schizosaccharomyces pombe mutants harboring single and multiple alfa-galactosyltransferase genes disruptions.
Glycobiology 21, 340-351 (2011)