はじめに
フコイダンは様々な生物学的活性、例えば抗酸化、抗凝固、抗炎症、抗がん効果などを呈することが知られており、 酵素消化で低分子化したフコイダン(Low molecular weight fucoidan、以下“LMF”と称す)においても同様の効果が報告されています(文献1,2)。
一方、ナタマメ (Canavalia gladiata、以下“CG”と称す)由来抽出物にも培養がん細胞に対して細胞死誘導作用等を呈することが報告されています(文献3,4)。 これらの背景情報から、両者を併用することで抗がん作用においての相乗効果が期待できます。 そこで、両者を混合した「LMF-CG」を開発し、その抗がん細胞効果を「LMF」単独使用で惹起する抗がん細胞効果を4種のがん細胞と1種の正常細胞を供試して検討しました。
これまでにナタマメエキスとLMFの併用による抗がん作用増強が確認されています。 今回はLMFにナタマメエキスを添加したLMF-CGのがん細胞増殖抑制効果を検討しました。 実験にはヒト正常線維芽細胞TIG-1、ヒト線維肉腫由来細胞株HT1080、ヒト卵巣がん由来細胞株 NIH:OVCAR-3、ヒト肝がん由来細胞株HepG2および、ヒト肝がん由来細胞株HuH-7 を使用しました。 細胞を1×103〜4×103個/wellで96-wellマイクロプレートに播種し24 時間培養しました。 LMFまたはLMF-CG 存在下で48 時間培養した後、細胞呼吸活性をWST-1アッセイで測定しました。
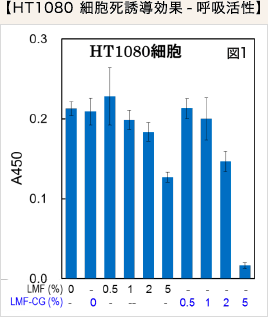
LMF 単独処理ならびにLMF-CG 処理ががん細胞におよぼす増殖抑制効果を検討しました。 WST-1 アッセイの結果より、HT1080細胞におけるサンプル添加濃度依存的な細胞増殖抑制効果が確認され、LMFとナタマメエキスを併用したことによるがん細胞増殖抑制の増強が確認されました(図1)。
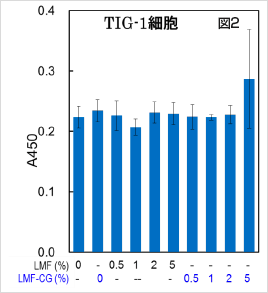
TIG-1 正常細胞においては10%までのLMF またはLMF-CG 処理による顕著な細胞増殖抑制効果は認められませんでしたが、10%を超えるLMF-CG 処理では細胞増殖抑制効果が認められました(図2)。
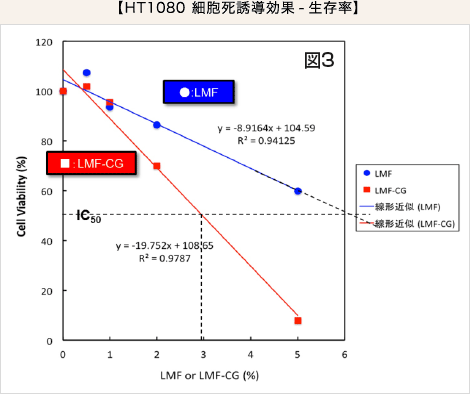
HT1080 細胞においてIC50(50%阻害濃度)を算出したところ、LMF のIC50が6.12%、そしてLMF-CG のIC50が2.97% となったことから、LMF-CG はLMF の約2倍の効果を有すると考えられました(図3)。
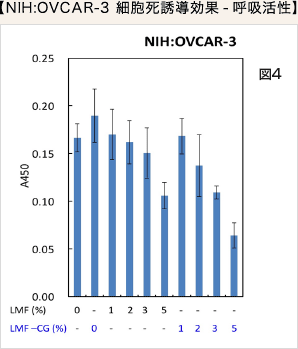
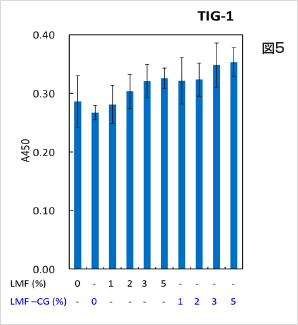
LMF 又はLMF-CG 単独ではNIH:OVCAR-3 がん細胞において、細胞死誘導効果は容量依存的に強くりますが、LMF-CG では、その効果がより強く、5%添加では細胞死を強く誘導しました(図4)。正常細胞においては細胞増殖を誘導する作用を示しました(図5)。
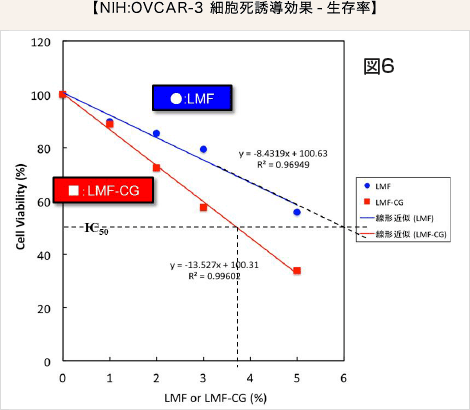
LMF 又はLMF-CG 単独ではOVCAR-3 がん細胞の生存率は容量依存的に低くなりますがLMF-CG では、その効果がより強く、IC50はLMF では6.0%、LMF-CG では3.7%でした。従って、LMF-CGはLMFの効果を約1.6 倍増強していました(図6)。
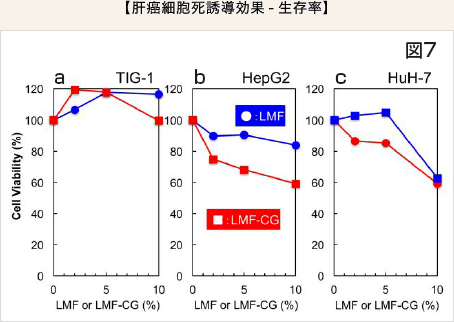
HepG2 細胞においてはLMF 単独での増殖抑制効果は弱いもののLMF-CG ではより強い効果、すなわち生存率は容量依存的に低下しました(図7b)。HuH-7 細胞では5%では効果が見られるが、10%濃度では両者に差は認められませんでした(図7c)。TIG-1 正常細胞に対するLMF 又はLMF-CG の細胞増殖抑制効果は認められませんでした(図7a)。
まとめ
・HT1080 細胞(線維肉腫由来)におけるIC50を算出したところ、LMF-CG はLMF の約2 倍の効果を示しました。
・OVCAR-3 細胞(卵巣がん由来)におけるIC50を算出したところ、 LMF-CG はLMF の約1.6倍の効果を示しました。
・HepG2 細胞(肝がん由来)に対するLMF-CGの阻害効果はLMF より高いことが判明しました。一方、HuH-7 細胞(肝がん由来)に対するLMF-CGの阻害効果は見られず、LMF と同じ傾向を示しました。
考察
LMF-CG の肝がん細胞に対する阻害効果の違いの解明には、今後の研究が待たれます。HepG2細胞 は野生型腫瘍抑制遺伝子産物p53 タンパク質産生、 HuH-7 は変異型腫瘍抑制遺伝子産物p53 タンパク質細胞株の特徴を持つとされており(文献5)、このp53 タンパク質の標的遺伝子であるp21 タンパク質の発現が予後の悪さ、肝がんの進行促進とに有意に関連しているとされています。変異型p53 はアポトーシスを惹起できないとされています(文献6)。フコイダンがHepG2 細胞ではアポトーシスを誘導するが野生型p53 の上方制御を伴っているとする報告もあります(文献7)。また、p53-p21 経路が球状コロニーの形成すなわちがん幹細胞形成に関わっている可能性も示唆されています(文献8)。これらのことからLMF-CGのHuH-7 細胞に対する阻害効果が低いことは変異型p53 タンパク質による影響かも知れません。
引用文献
文献1: Z. Zhang et al., Marine Drugs (2013)
11, 81-98.
文献2 : Z. Zhang et al., Bioscience,
Biotechnology, and Biochemistry (2013) 77,
235-242.
文献3: T. Yau et al., Molecules (2015) 20,
3791-3810.
文献4: Z. Liu et al., Cell Proliferation (2013)
46, 509-515.
文献5: W.S. Moon et al., Human Pathology
(2004) 35, 424-429.
文献6: K.G. Wiman, Advances in Cancer
Research (2007) 97, 321-338.
文献7: S. Roshan et al., Journal of Huazhong
University of Science and Technology [Medical
Sciences] (2014) 34, 330-326.
文献8: Y. Uchida et al., Oncology Reports
(2010) 24: 1147-1151.

