テーマ紹介: 乳酸菌および類縁菌が生産するランチビオティックに関する研究
乳酸菌をはじめとするグラム陽性菌が生産するバクテリオシンの中には翻訳後修飾によって生じる不飽和アミノ酸であるデヒドロアラニンや、モノスルフィド結合を有するランチオニンなどの異常アミノ酸をもつものがある。これらはランチビオティックと総称され、クラスIバクテリオシンに分類される。ランチオニンなどの異常アミノ酸を有するペプチドはランチペプチドとも呼ばれる。最も代表的な乳酸菌バクテリオシンであるナイシンAもランチビオティックに分類される。我々は乳酸菌やその類縁菌から新奇ランチビオティックを探索し、構造や生合成機構、作用機構の解析を進めるとともに、抗菌剤としての応用を検討している。
1.乳酸菌が生産する新奇ランチビオティック(論文1~4)
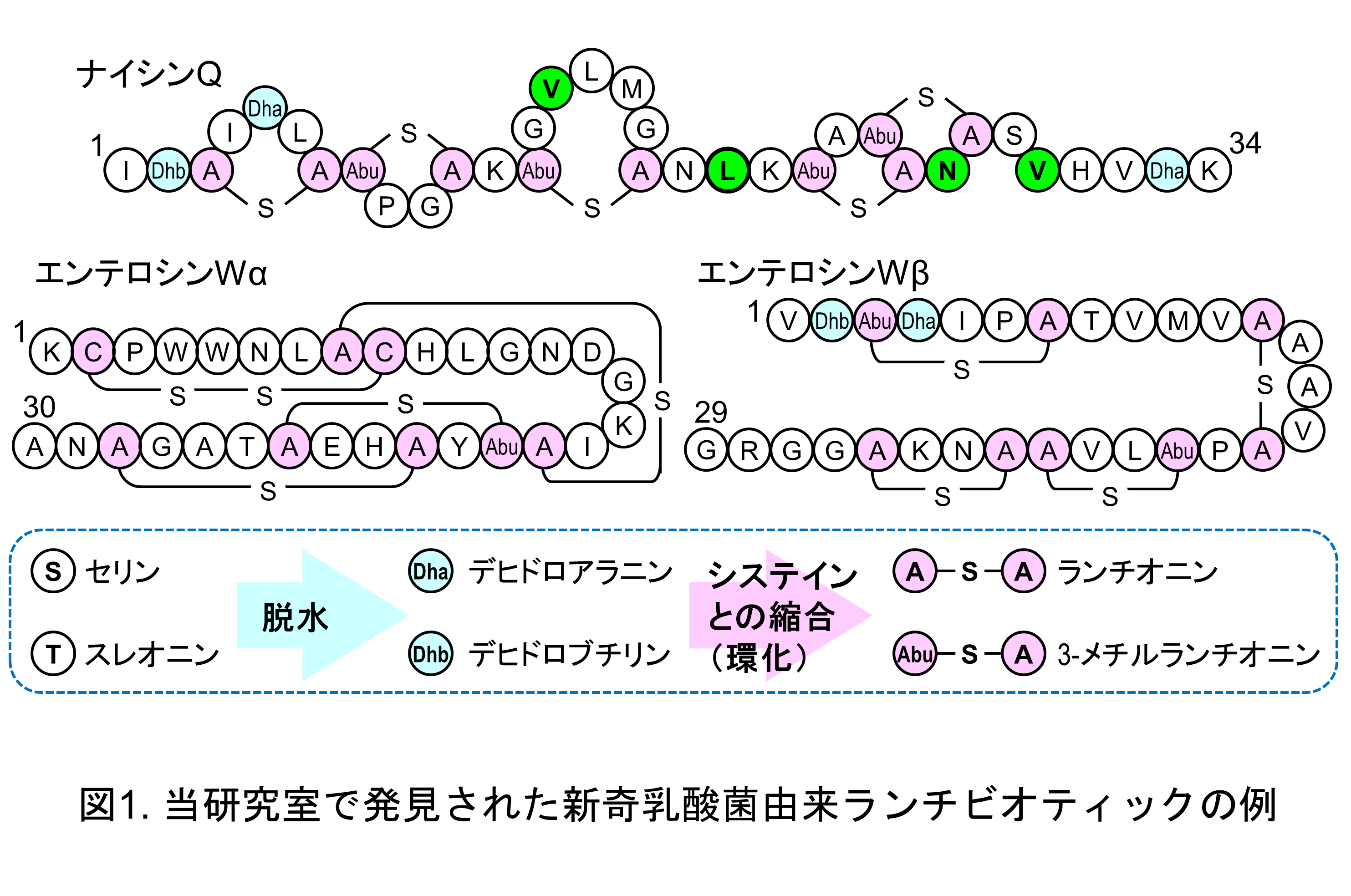
河川水から分離した乳酸菌Lactococcus lactis 61-14からナイシンA・Zに続く第三のナイシン類縁体としてナイシンQを発見した(図1)。ナイシンAとは同様の架橋パターンを保持しながらも4つのアミノ酸残基が異なり、ナイシンA・Zと同様の生合成遺伝子群によって生合成されることが明らかとなっている。また、発酵魚から分離した乳酸菌Enterococcus faecalis NKR-4-1からは新奇二成分ランチビオティックであるエンテロシンWを発見し(図1)、2つのペプチド(WαとWβ)が相乗的に抗菌活性を示すことを明らかにした。
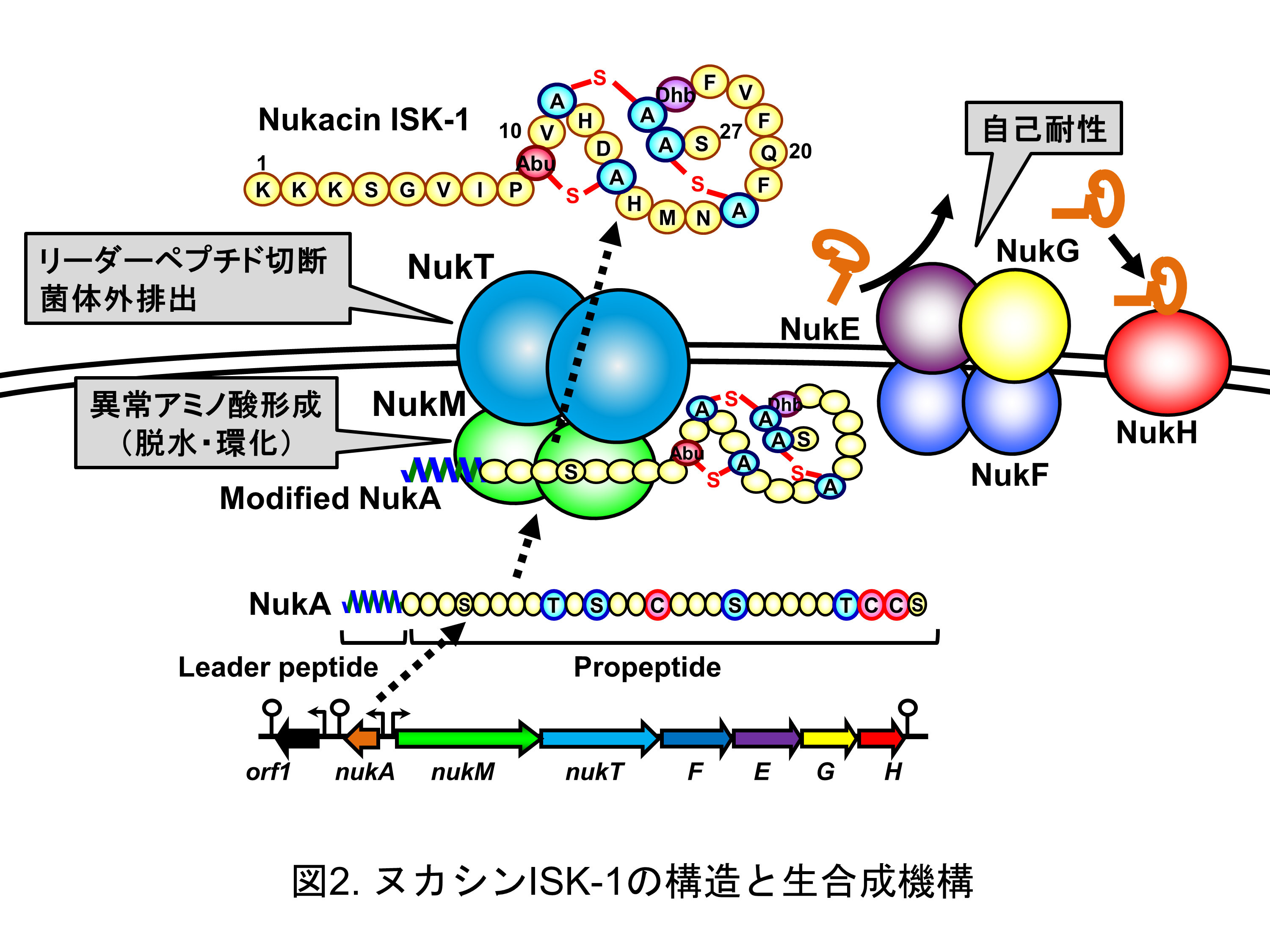
2.表皮ブドウ球菌が生産するヌカシンISK-1(論文5,6)
乳酸菌に近い性質をもつ表皮ブドウ球菌で、ぬか床から分離したStaphylococcus warneri ISK-1からは、ヌカシンISK-1を発見した(図2)。ヌカシンISK-1の生合成機構(図2)や作用機構について広く研究が進められ、異常アミノ酸形成機構、分泌機構、自己耐性機構、標的分子の認識機構などが明らかになっている。また、生合成機構を利用した新奇ランチペプチドの創出についても検討を進めてきた。ヌカシンISK-1やその類縁体は、同じく発酵食品から分離した表皮ブドウ球菌S. hominisなどからも見出された。
発表論文
【発表論文】
1. Zendo T, Fukao M, Ueda K, Higuchi T, Nakayama J, Sonomoto K. Identification of the lantibiotic nisin Q, a new natural nisin variant produced by Lactococcus lactis 61-14 isolated from a river in Japan. Biosci Biotechnol Biochem. 2003 Jul;67(7):1616-9. doi: 10.1271/bbb.67.1616. PMID: 12913315.
2. Fukao M, Obita T, Yoneyama F, Kohda D, Zendo T, Nakayama J, Sonomoto K. Complete covalent structure of nisin Q, new natural nisin variant, containing post-translationally modified amino acids. Biosci Biotechnol Biochem. 2008 Jul;72(7):1750-5. doi: 10.1271/bbb.80066. Epub 2008 Jul 7. PMID: 18603791.
3. Yoneyama F, Fukao M, Zendo T, Nakayama J, Sonomoto K. Biosynthetic characterization and biochemical features of the third natural nisin variant, nisin Q, produced by Lactococcus lactis 61-14. J Appl Microbiol. 2008 Dec;105(6):1982-90. doi: 10.1111/j.1365-2672.2008.03958.x. PMID: 19120645.
4. Sawa N, Wilaipun P, Kinoshita S, Zendo T, Leelawatcharamas V, Nakayama J, Sonomoto K. Isolation and characterization of enterocin W, a novel two-peptide lantibiotic produced by Enterococcus faecalis NKR-4-1. Appl Environ Microbiol. 2012 Feb;78(3):900-3. doi: 10.1128/AEM.06497-11. Epub 2011 Dec 2. PubMed PMID: 22138996; PubMed Central PMCID: PMC3264125.
5. Shimafuji C, Noguchi M, Nishie M, Nagao J, Shioya K, Zendo T, Nakayama J, Sonomoto K. In vitro catalytic activity of N-terminal and C-terminal domains in NukM, the post-translational modification enzyme of nukacin ISK-1. J Biosci Bioeng. 2015 Dec;120(6):624-9. doi: 10.1016/j.jbiosc.2015.03.020. Epub 2015 May 9. PubMed PMID: 25971839.
6. Zheng S, Nagao JI, Nishie M, Zendo T, Sonomoto K. ATPase activity regulation by leader peptide processing of ABC transporter maturation and secretion protein, NukT, for lantibiotic nukacin ISK-1. Appl Microbiol Biotechnol. 2018 Jan;102(2):763-772. doi: 10.1007/s00253-017-8645-2. Epub 2017 Nov 22. PMID: 29167920.
7. Fujinami D, -Mahin AA, Elsayed KM, Islam MR, Nagao JI, Roy U, Momin S, Zendo T, Kohda D, Sonomoto K. The lantibiotic nukacin ISK-1 exists in an equilibrium between active and inactive lipid-II binding states. Commun Biol. 2018 Sep 25;1:150. doi: 10.1038/s42003-018-0150-3. PMID: 30272026; PMCID: PMC6156582.
8. Wilaipun P, Zendo T, Okuda K, Nakayama J, Sonomoto K. Identification of the nukacin KQU-131, a new type-A(II) lantibiotic produced by Staphylococcus hominis KQU-131 isolated from Thai fermented fish product (Pla-ra). Biosci Biotechnol Biochem. 2008 Aug;72(8):2232-5. doi: 10.1271/bbb.80239. Epub 2008 Aug 7. PMID: 18685189.
メンバー紹介・研究テーマ
【2020年度】
