抗がん剤と低分子化フコイダンを併用したときにどうなるのか? ヒトのがん細胞を用いた実験で調べました。トリパンブルーによる死細胞を染色する方法、細胞周期解析法(サブG1解析)という2つの方法で抗がん剤と低分子化フコイダンの併用試験を行いました。使用した抗がん剤はシスプラチンとマイトマイシンCです。シスプラチンは数多くのがんに有効性が認められている白金製剤で、現在の抗がん剤治療の中心的な役割を果たしています。しかし、激しい副作用があり、深刻な場合は腎臓機能に障害をもたらします。また、抗がん性抗生物質のマイトマイシンCはDNAの分裂阻止やDNAの複製を阻害し、抗がん作用を発揮します。副作用としては骨髄抑制が他の抗がん剤と比べて起こりやすく、感染症や貧血、出血傾向に対する注意が必要です。軽度の場合が多いものの腎障害も起こりやすくなります。
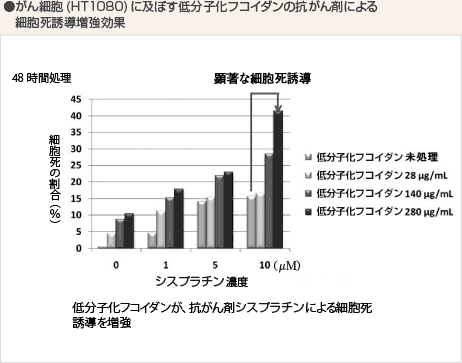
まず、がん細胞(HT1080細胞)に濃度を変えたシスプラチンと低分子化フコイダンを加え、がん細胞が細胞死を起こす割合を調べてみました。すると、低分子化フコイダンを加えていない場合に比べ、2倍強の細胞死誘導作用があることがわかりました。
一方、正常細胞(TIG-1)において同様の実験を行った結果からは、抗がん剤シスプラチンの細胞死誘導が低分子化フコイダンにより抑制されていました。
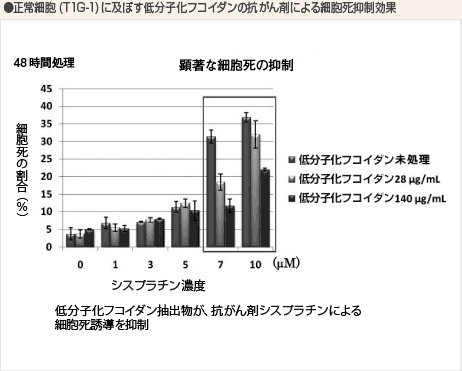
つまり、がん細胞に対しては抗がん剤シスプラチンと低分子化フコイダンの双方が細胞死誘導を促進していると考えられます。一方、正常細胞に対しては抗がん剤シスプラチンが与えるダメージを低分子化フコイダンが抑制している効果が見られました。
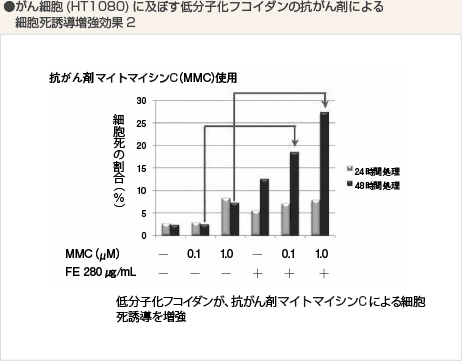
また、マイトマイシンと低分子化フコイダンとの併用試験においても同様に双方が細胞死誘導を促進する結果となっています。
さまざまな研究の末に開発された抗がん剤でも、正常細胞とがん細胞を識別するのは困難です。しかし、海藻由来の低分子化フコイダンはがん細胞だけに作用します。この特異的なメカニズムについて解説をしておきたいと思います。
少し専門的になりますが、これは2010年9月の第69回日本癌学会学術総会で私たちが発表しています。
正常な細胞ががん細胞に変化する過程で何が起こるか。糖鎖合成経路に変化が起こります。
糖鎖とは各細胞をつなぐネットワークのようなものです。
そのとき、表面糖鎖の構造が変わるため、糖鎖認識タンパク質のレクチンの一種であるコンカナバリンA(Con A)に対する結合性が変化します。このことは古くから知られています。
私たちはフコイダン処理により、多くのがん細胞でのCon A結合性の度合いが高まるとともに、がん細胞のアポトーシス死が増強されることを見出しました。
作用機構を調べたところ、正常細胞ががん化する過程で共通して増強される酵素のひとつであるN−アセチルグルコサミン転移酵素(GnT-V)の遺伝子発現がフコイダンにより顕著に抑制されることがわかりました。また、GnT-Vの遺伝子発現を調節するタンパク質Ets-1の遺伝子発現も顕著に抑制されました。
GnT-VもEts-1もがん細胞の転移・浸潤などの悪性の性質に深く関わっていることから注目されているタンパク質です。
このことから、低分子化フコイダンががん細胞の異常な糖鎖合成経路を抑制し、表面糖鎖に変化を起こしてアポトーシスを起こしやすくしていると思われます。
低分子化フコイダンに多量に含まれるフコースは表面糖鎖の働きを正常に保つうえでも、がん細胞を特異的に殺す腫瘍免疫でも、大変重要な働きをしていることが知られています。正常細胞ではもともとGnT-VおよびEts-1の遺伝子発現は低く抑えられており、低分子化フコイダンを作用させても大きな変化は認められませんでした。
がん細胞と正常細胞の違いを見わけるのは科学的には非常に難しいことですが、低分子化フコイダンは細胞を識別し、選択性を発揮して変異した細胞だけをアポトーシスに導いていきます。


